
Die Irreführung mit der Kohlen-„Säure“
von Fred F. Mueller
Da auch Wissenschaftler essen müssen, ist Wissenschaft nicht frei von Eigeninteressen. Die Mehrzahl aller wissenschaftlichen Institutionen ist heute auf das ständige Einwerben von Forschungsgeldern angewiesen. Um diese zu erhalten, müssen sie Projektthemen anbieten, die den Wünschen der externen Geldgeber entsprechen. Letztere vertreten heute aus politischen Gründen weitgehend unisono die Theorie von der „menschengemachten Klimakatastrophe“. Die Institutsleiter, die sich ständig Sorgen über die Beschäftigung eines Großteils ihrer Mitarbeiter und ihrer Ausrüstung machen müssen, bieten deshalb meist „genehme“ Themen und dazu passende Theorien an. Das ist die Ursache des vielfach beschworenen „Konsens der Wissenschaft“ im Bereich der Klimaforschung und gilt auch für die Meereswissenschaften, genauer gesagt für die dort vertretene Theorie der angeblichen „Meeresversauerung durch CO2“.
Um zu verstehen, was es damit auf sich hat, müssen wir uns die Eigenschaften der entsprechenden Moleküle näher ansehen. Wasser ist neben Kohlenstoff eine entscheidende Voraussetzung für alles Leben auf der Erde. Es ist zugleich das beste in der Chemie bekannte Lösungsmittel, das eine Vielzahl organischer und anorganischer Substanzen lösen kann. Ohne die besonderen Eigenschaften des Wassers wäre die komplexe Chemie, auf welcher der gesamte Stoffwechsel in unseren Zellen beruht, gar nicht möglich. Diese Löslichkeit ist abhängig von der Natur der zu lösenden Stoffe. Teils ist sie erstaunlich hoch, beispielsweise bei Zucker oder Salz, teils mäßiger wie z.B. beim Kalkstein, der von Regenwasser langsam, aber stetig angelöst wird, so dass sich im Lauf vieler Jahre Höhlen und Tropfsteine bilden. Aber selbst Stoffe, die man normalerweise als unlösbar einstufen würde – wie die meisten Steine, Erze und Metalle – sind in den Weltmeeren in erstaunlich großen Mengen anzutreffen. Zwar sind die Löslichkeiten teilweise im Bereich Milliardstel g/l oder noch niedriger, doch muss man sich auf der anderen Seite auch die ungeheure Größe der Weltmeere vergegenwärtigen. In den rund 1,37 Mrd. Kubikkilometer der Ozeane befinden sich immerhin 20 Mio. t Gold [GOLD] und sogar 4,5 Mrd. t Uran [URAN]. Man vergleiche dies z.B. mit den weltweiten Goldvorräte von lediglich rund 30.000 t.

Bild 1. Auch diese wunderschöne Rote Helmschnecke (Cassis Rufa) soll von der angeblichen Meeresversauerung bedroht sein
Ursachen der hohen Löslichkeit: Ein „krummes“ Molekül…
Ein entscheidender Grund für die hohe Löslichkeit des Wassers liegt in der besonderen Anordnung seiner Atome. Beim H2O-Molekül befinden sich die beiden Wasserstoff-Atome nämlich nicht auf genau gegenüberliegenden Seiten des Sauerstoffatoms. Stattdessen bilden sie ein Dreieck, Bild 2.
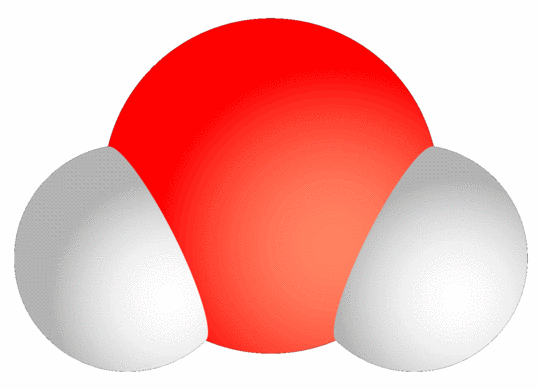
Bild 2. Das Wassermolekül hat die Form eines Dreiecks mit einem Öffnungswinkel von etwa 104° (Grafik: Sakurambo, [WIDI])
Die Folge dieser unsymmetrischen Anordnung ist eine ungleichmäßige Verteilung der elektrischen Ladungen innerhalb des Moleküls. Während die beiden positiv geladenen Wasserstoffkerne („Protonen“) auf ihrer Seite ein Übergewicht an positiver elektrischer Ladung bedingen, wird dies auf der anderen Seite des Sauerstoffatoms durch eine entsprechend negative Ladung ausbalanciert. Obwohl das Molekül als Ganzes gesehen elektrisch neutral ist, stimmen in seinem Inneren die „Schwerpunkte“ der positiven und der negativen Ladungen nicht überein. Man spricht in einem solchen Fall von einem permanenten elektrischen Dipol. Diese Eigenschaft ist beim Wassermolekül besonders ausgeprägt. In der Praxis führt das dazu, dass sich das Molekül sowohl an positiv als auch an negativ geladene Ionen anlagern kann, indem es dem betreffenden Ion die jeweils „passende“ Seite zukehrt, Bild 3. Um dieses Ion herum bildet sich dadurch eine sogenannte Hydratationshülle.

Bild 3. Bei einem Ionenkristall wie dem NaCl (Kochsalz) drehen zahlreiche Wassermoleküle den einzelnen Ionen des Salzes die jeweils „passende“ Seite zu und maskieren so deren Ladung (Grafik: [INTE])
Aufgrund dessen verlieren diese „hydratisierten“ Gitterionen – ausgehend von den Ecken, wo die elektrostatischen Anziehungskräfte des Gitters geringer sind als auf den Flächen – den Kontakt zum restlichen Kristall und werden durch die ständige Bewegung der Flüssigkeitsteilchen gleichmäßig im gesamten Volumen verteilt.
Dies ist die Ursache für die sehr gute Löslichkeit von Wasser für viele Salze. Darüber hinaus gibt es auch zahlreiche sogenannte hydrophile Stoffe wie z.B. Harnstoff, die sich ebenfalls leicht in Wasser lösen, sowie manche Gase wie Stickstoff, Sauerstoff oder CO2.
…und „Brücken“ aus Wasserstoff
Eine weitere Folge des Dipolmoments der Wassermoleküle ist ihre Fähigkeit, sogenannte Wasserstoffbrücken zu bilden. Dies erfolgt durch Andocken der elektropositiv geladenen Wasserstoffatome zweier fremder Wassermoleküle am elektronegativ geladenen Sauerstoffatom eines weiteren Wassermoleküls. Somit kann jedes Wassermolekül vier Wasserstoffbrückenbindungen eingehen: Mit seinen Wasserstoffatomen bindet es sich an die Sauerstoffatome von zwei fremden Wassermolekülen, mit seinem eigenen Sauerstoffatom koppelt es an die Wasserstoffatome von zwei weiteren Wassermolekülen, Bild 4. Deshalb haben wir es im flüssigen und festen Zustand immer mit großen Gruppen von Molekülen zu tun, die über Wasserstoffbrücken verbunden sind. Nur als Gas („Wasserdampf“) liegen die Wassermoleküle tatsächlich einzeln vor.
Diese Wasserstoffbrückenbindung ist zwar erheblich schwächer als die bekannte kovalente (atomare) Bindung oder als die Ionenbindung, doch reicht sie immerhin aus, um die Siedetemperatur von Wasser von den eigentlich zu erwartenden -80 °C auf die bekannten 100 °C anzuheben. Erst bei 100 °C reicht die thermische Bewegungsenergie der Wassermoleküle aus, um die Bindungskräfte der Wasserstoffbrücken quantitativ zu überwinden und in die Gasphase überzugehen. Diese Wasserstoffbrückenbindung ist entscheidend für zahlreiche biochemische Reaktionen, darunter auch für den Zusammenhalt der DNA-Helix im Erbgut. Auch die Auflösung von Zucker erfolgt über die Bildung von Wasserstoffbrücken zwischen den Molekülen des Zuckers und des Wassers.
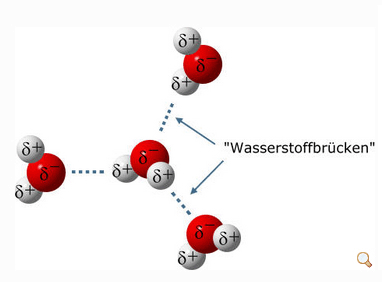
Bild 4. Wasserstoffbrücke (Grafik: [CHEM])
Sauer und basisch – die Dissoziation des Wassers
Dritter „Pfeil“ im Köcher des Wassers, wenn es um die Möglichkeit einer Reaktion mit anderen Molekülen und Verbindungen geht, ist der Zerfall einer geringen Zahl von H2O-Molekülen in positiv geladene Wasserstoffionen (Protonen, H+) einerseits und negativ geladene OH–Ionen andererseits. Von dieser Dissoziation ist im Prinzip nur ein verschwindend geringer Anteil betroffen: Bei 25 °C ist es gerade mal eines von 10 Mio. Molekülen.
Aufgrund eines physikalischen Gesetzes (Massenwirkungsgesetz) liegt die Konzentration der Protonen multipliziert mit der Konzentration der OH–Ionen bei recht exakt 10-14. Dieses sogenannte Ionenprodukt des Wassers ist eine in erster Näherung lediglich von der Temperatur abhängige Konstante. Bei Neutralität gilt, dass die Zahl der positiv und negativ geladenen Ionen identisch ist: Beide liegen demnach in einer Konzentration von 10-7 vor, solange sich die Partner der Reaktion im Gleichgewicht befinden:
H2O H+ + OH–
(Die gegenläufigen Halbpfeile weisen darauf hin, dass sich zwischen dem rechten und dem linken Teil der Gleichung ein Gleichgewicht bildet). Bringt man in das Wasser jetzt Reagenzien ein, welche einen der beiden Partner bevorzugt binden, so erhöht bzw. senkt man die jeweiligen Konzentrationen im exakten Gegenlauf , weil ihr Produkt ja konstant bleibt. Nimmt man beispielsweise einen Säurebildner wie das Oxid des Phosphors (P2O5, Phosphorpentoxid) so reagiert dieses mit drei Wassermolekülen zu Phosphorsäure:
P2O5 (S) + 3 H2O 2 H3PO4 (AQ) 6 H+ (AQ) + 2 PO43-(AQ)
(das (S) steht für Festkörper (solid) und das (AQ) für wässrige Lösung (aqua).
Das Resultat ist, dass der Lösung drei OH–Ionen entzogen werden, während gleichzeitig sechs Protonen hinzukommen. Dadurch steigt die Konzentration der Protonen, während diejenige der OH–Ionen zurückgeht. Der Chemiker definiert nun, dass eine Erhöhung der Protonenkonzentration auf mehr als 10^-7 bewirkt, dass sich die Lösung „sauer“ verhält, während sie im anderen Fall eine auf weniger als 10^-7 verringerte Protonenkonzentration als „basisch“ bezeichnet wird. Als Kenngröße für solche Verschiebungen dient den Chemikern traditionell der sogenannte pH-Wert. Da die Protonenkonzentration eine enorme Variationsbreite von 10^14 Stellen überstreicht, verwendet man zur Vereinfachung einen Logarithmuswert, und zwar den negativen 10er-Logarithmus der Protonenkonzentration. Der pH-Wert variiert in der Regel zwischen 0 (stark sauer) und 14 (stark basisch), Bild 5, kann bei sehr starken Säuren bzw. Basen aber auch über diese Skala hinausgehen.

Bild 5. Schematische Darstellung der pH-Skala und der gegenläufigen pOH-Skala. Rot kennzeichnet den sauren und blau den basischen Bereich (Grafik: PatríciaR [WIPH])
Reines Wasser ist ein unerreichbares Ideal
Alle drei beschriebenen Mechanismen bewirken in ihrem Zusammenwirken die bereits angesprochene enorme Bandbreite an Stoffen, welche Wasser lösen kann, selbst wenn die Löslichkeit fallweise nur gering ist. Deshalb findet man in den Meeren auch eine geradezu unübersehbare Vielzahl an Elementen und Verbindungen in gelöster Form. Auf der anderen Seite bedingt dies, dass es in der Praxis kein „reines“ Wasser gibt. Deshalb reagieren selbst die Regentropfen, sie sich in der Atmosphäre bilden und im Prinzip aus destilliertem Wasser bestehen, sofort mit der Atmosphäre, indem sie Gase aufnehmen. Besonders haben sie es dabei auf ein eigentlich recht stabiles Molekül abgesehen, das bei der Oxidation von Kohle entsteht: Das Kohlenstoffdioxid CO2.
Was ist eigentlich Kohlen-„Säure“?
Die sogenannte Kohlensäure entsteht, nachdem sich das atmosphärische Spurengas CO2 in Wasser gelöst hat. Dabei reagiert ein (sehr kleiner) Teil der CO2-Moleküle mit Wassermolekülen und bildet dabei die Kohlensäure H2CO3. Diese dissoziiert teilweise wiederum in zwei Stufen. Zunächst zerfällt sie zu einem Proton und dem sogenannten Bicarbonat-Ion HCO3-, welches dann nochmals weiter zu einem weiteren Proton und dem Carbonation CO32- dissoziiert, Bild 6.
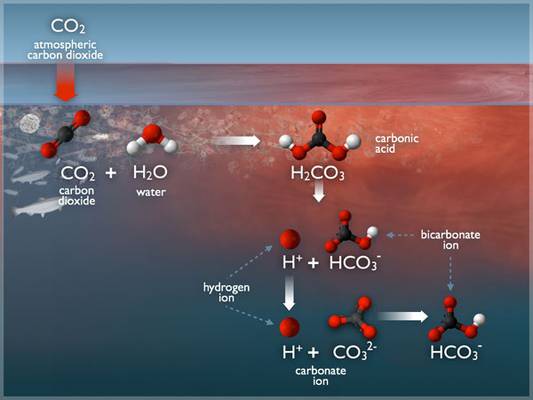
Bild 6. Darstellung der Reaktionen von CO2, Kohlesäure und Carbonat sowie Hydrogencarbonat in Wasser (Grafik: [OZEA])
Zu diesen Reaktionen ist anzumerken, dass das Gleichgewicht dann, wenn keine Pufferung (Erklärung hierzu folgt weiter unten) vorliegt, auf der linken Seite liegt, d.h. das CO2 überwiegt. Sein Verhältnis zur Kohlensäure beträgt ca. 700/ 1. Als relativ schwache Säure dissoziiert die Kohlensäure nur in geringem Maße.
Dies trifft beispielsweise auf frisch gefallenes Regenwasser zu, das sogenannte pristine Regenwasser. Solches Wasser hat noch keinen Kontakt zum Erdboden gehabt und deshalb noch keine nennenswerte Fracht an mineralischen oder organischen Säure- oder Basebildnern wie z.B. Calciumionen aufgenommen, welche ihrerseits mit Protonen oder OH–Ionen reagieren und dadurch deren Konzentration (und damit den pH-Wert) beeinflussen könnten. Solange solche Einflüsse fehlen, reagiert das Regenwasser schon auf die vergleichsweise geringe Menge des während des Falls durch die Atmosphäre aufgenommenen CO2 mit einer erheblichen Absenkung des pH-Werts. Es hat deshalb häufig einen pH-Wert von um die 5,5 (schwach sauer). Dennoch reicht dieser „saure“ Charakter aus, um Gesteine anzugreifen, aus denen unter anderem Calciumcarbonat CaCO3 (Kalk) gelöst wird, der mit den Hydrogencarbonationen dann zu Calciumhydrogencarbonat (Ca(HCO3)2) reagiert. Während Kalk in Wasser nur in geringem Umfang löslich ist, weist das Calciumhydrogencarbonat eine recht gute Löslichkeit auf. Es gelangt mit dem Trinkwasser z.B. in Hausleitungen, wo es bei Erwärmung zu Kalk CaCO3 und CO2 zerfällt. Der Gehalt des Calciumhydrogencarbonats im Wasser ist als sogenannte Carbonathärte die Hauptursache für die Verkalkung von Wasserleitungen und Armaturen. Letztlich landet jedoch der größte Teil dieser Mineralfracht über die Flüsse in den Ozeanen.
Von „Gleichgewichten“, „Puffern“ und „Milieus“
An dieser Stelle kommen noch einige weitere Mechanismen ins Spiel, die für das Verständnis der Wasserchemie unabdingbar sind. Dazu gehört zunächst einmal der Begriff des „Gleichgewichts“. Wenn wir beispielsweise Kohle verbrennen, so ist dies eine „Einweg“-Reaktion. Bei dieser verbinden sich Kohlenstoff und Sauerstoff zu CO2, das in die Luft entweicht. Eine Umkehr ist auf normalem Wege nicht möglich.
Im Wasser verlaufen sehr viele Reaktionen dagegen reversibel und nur bis zu einem gewissen Punkt, ab dem sie zum Stillstand kommen. Ähnlich wie bei der Dissoziation des Wassers selbst befinden sich die Reaktionspartner auf beiden Seiten der Gleichung dann in einem dynamischen Gleichgewicht. Anders ausgedrückt heißt dies, dass auf der molekularen Ebene ständig beide Reaktionsrichtungen durchlaufen werden. Dieses Gleichgewicht bestimmt die Massenverhältnisse zwischen der einen und der anderen Seite. Verändert man jetzt wesentliche Parameter auf einer Seite, dann verschieben sich auch die Massenverhältnisse zwischen den beiden Seiten der Reaktionsgleichung.
Das zweite Grundprinzip ist der Puffer. Ein Puffer ist – vereinfacht ausgedrückt – ein Speicher bzw. ein Vorrat, der einen der Reaktionspartner eines Gleichgewichtssystems enthält. Einfaches Analogon ist ein Glas Wasser, das man zu etwa 1/3 mit Kochsalz füllt, um dann Wasser bis zum ¾-Stand hinzuzufügen. Dadurch wird sich zunächst Salz auflösen, bis ein Sättigungsgrenzwert von etwa 26,3 % erreicht ist. Das restliche Salz bildet einen Bodensatz, der sich selbst durch noch so intensives Rühren nicht auflösen wird. Ab diesem Punkt wird an den Grenzflächen zwischen den Kristallen und dem Wasser ständig Salz in Lösung gehen und im Gegenzug genausoviel Salz aus dem Wasser wieder auskristallisieren. Fügt man jetzt Wasser hinzu, so wird weiteres Salz aufgelöst. Verdunstet dagegen ein Teil des Wassers, so wird die dem Gleichgewichtszustand entsprechende Menge Salz am Boden ausfallen. Solange noch festes Salz vorhanden ist, sorgt dieser Puffer demnach dafür, dass die Salzlösung darüber auch bei Schwankungen des Wasserstands immer die gleiche Konzentration aufweist. Bei diesem Beispiel finden übrigens keine chemischen Reaktionen statt, man könnte daher streng genommen von einem physikalischen Puffer sprechen. Aber auch die Partner von chemischen Gleichgewichtsreaktionen wirken oft als Puffersysteme, so z.B. beim Zusammenwirken von schwachen Säuren und starken Basen.
Der dritte Aspekt betrifft schließlich die Berücksichtigung des physikochemischen Gesamtumfeldes, des sogenannten Milieus. Wasser bzw. wässrige Lösungen können eine Vielzahl weiterer Moleküle und Ionen enthalten, die Einfluss sowohl auf die Löslichkeit einer Substanz als auch auf den pH-Wert haben und/ oder eine Pufferwirkung entfalten. Entscheidender Faktor ist hierbei die Fixierung des pH-Werts auf einem bestimmtem Niveau. So gelten für die Reaktionen von CO2 mit Wasser im Ozean mit seiner riesigen Fracht an Reagenzien ganz andere Voraussetzungen als z.B. bei pristinem Regenwasser, Bild 7.
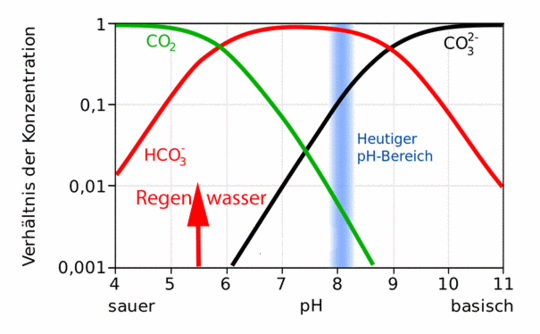
Bild 7. Ergänzte Darstellung der Konzentrationsverhältnisse von HCO3, CO32- und CO2/H2CO3. Diese hängen vom pH-Wert ab. Der rote Pfeil gilt für pristines Regenwasser, der blaue Bereich kennzeichnet die Zustände in Meerwasser (Grafik BeAr, [WIME])
Der Blut-Carbonatpuffer des CO2
Ein anschauliches Beispiel für die Wirkungsweise eines chemischen Puffers liefern die Reaktionsprodukte des CO2 in bestimmten wässrigen Milieus. Besonders bekannt ist der sogenannte Carbonatpuffer im menschlichen Blut, das bekanntlich eine Vielzahl weiterer anorganischer und organischer Reagenzien enthält. Hier wirkt die oben bereits vorgestellte Kohlensäure-Carbonat-Reaktion, statt wie beim Regenwasser eine schwache Säure zu bilden, als Puffer zum Auffangen von pH-Schwankungen im Blutkreislauf. Der pH-Wert des Bluts wird dabei im leicht alkalischen Bereich bei pH 7,4 stabilisiert [WIPU].
CO2 + H2O H2CO3 HCO3– + H+
Der Puffer besteht – analog zur Reaktion aus Bild 6 – aus der Kohlensäure (H2CO3) auf der einen Seite und Protonen sowie Carbonationen (HCO3−) auf der anderen Seite. Wenn das Blut nicht sauer genug ist, dissoziiert die Kohlensäure zu einem Proton und einem Carbonation. Wenn das Blut dagegen zu viele Protonen enthält, also zu sauer wird, bindet das Carbonation ein Proton und wird zur undissoziierten Kohlensäure, die anschließend zu Wasser und Kohlenstoffdioxid zerfällt. Das Gleichgewicht liegt hierbei aufgrund des Einflusses zahlreicher weiterer Reagenzien auf der Carbonatseite: In der Lösung ist rund 400 Mal soviel Carbonat wie Kohlensäure vorhanden. Im Endeffekt wird dadurch der pH-Wert des Blutes in engen Grenzen im leicht alkalischen Bereich (zwischen 7,35 und 7,45) stabilisiert. Die Regulierung erfolgt – von einem speziellen Bereich des Gehirns gesteuert – durch eine Steigerung oder Absenkung der CO2-Konzentration im Blut über die Atmung.
Bemerkenswert ist hieran, dass es sich im Prinzip um die gleiche chemische Reaktion handelt, wie sie auch in Regenwasser abläuft. Doch während sie beim ungepufferten Regenwasser bewirkt, dass dieses zu einer leichten Säure mit einem pH-Wert von um die 5,5 wird, stabilisiert sie im Blut einen viel höheren pH-Wert, der eindeutig im alkalischen Bereich liegt. Grund hierfür ist das ganz andere chemische Milieu, das durch die Anwesenheit einer Reihe biologisch wichtiger Ionen geprägt wird: Natrium (Na+), Kalium (K+), Calcium (Ca2+) und Chlorid (Cl–). Im Blut ist ein möglichst genau ausbalanciertes Verhältnis dieser vier Ionen von etwa 94:3:2:70 von essentieller Bedeutung [BLUT].
Das Erbe der Urzeit
Der Carbonatpuffer wirkt interessanterweise nicht nur im menschlichen Körper, sondern in modifizierter Form auch im Meer. Und nicht nur zufällig entspricht das Ionenverhältnis in unserem Blut auch recht gut demjenigen im Meer (Bild 8), wo es bei 94:2:2:100 liegt. Diese Zusammensetzung des Meerwassers ist eine Konstante der Entwicklung des heutigen Lebens, denn sie hat sich in den letzten ca. 700 Mio. Jahren kaum verändert. Unsere Zellen werden vom Blut, der Lymphe und anderen Körperflüssigkeiten in einem wässrigen Milieu umspült, ernährt und am Leben erhalten. Dieses Milieu weist bezüglich wesentlicher anorganischer Ionen und des pH-Werts große Übereinstimmungen mit dem Meerwasser auf. Dies ist nach Erkenntnissen der Evolutionsbiologie kein Zufall, sondern als Erbe unserer Abstammung von Meereslebewesen anzusehen [NEKA].
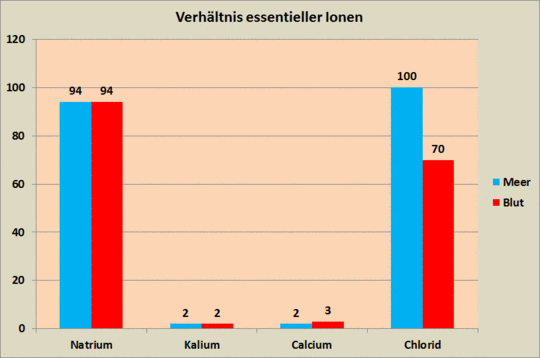
Bild 8. Die Verhältniszahlen essentieller Ionen in unserem Blut stimmen weitgehend mit denen im Meer überein (Grafik: Autor, Daten: [NEKA])
In diesem Zusammenhang fällt noch eine weitere Besonderheit auf: Der CO2-Partialdruck im Blut liegt wegen des im Vergleich zur Atmosphäre 100fach höheren CO2-Anteils in der Ausatemluft (4 % statt 400 ppm) um einen Faktor 100 höher als beim Regenwasser. Obwohl die CO2/-Carbonatreaktion im Prinzip die gleiche ist wie die im Regenwasser, bleibt der pH-Wert im Blut dennoch sicher im basischen Bereich. Im Regenwasser-Milieu würde der pH-Wert bei einem vergleichbar hohen CO2-Partialdruck mit etwa 3,5 bis 4 dagegen schon deutlich im sauren Bereich liegen. Der Blutpuffer liefert daher einen sehr deutlichen Hinweis darauf, dass selbst ein atmosphärischer CO2-Gehalt, der um den Faktor 100 höher läge als heute, in einem dem Meerwasser sehr ähnlichen Milieu keine „Versauerung“ herbeiführen würde, welche das Überleben von Organismen gefährden könnte.
Zudem gibt uns die Wirkungsweise des Blutpuffers auch einen Hinweis auf eine ferne Vergangenheit, in der sich viel mehr CO2 in der Atmosphäre befand als heute: Der sehr hohe CO2-Gehalt in der Ausatemluft bedingt, dass wir selbst gegen einen sehr viel höheren CO2-Partialdruck noch den gasförmigen „Verbrennungs-Abfall“ unseres Stoffwechsels ohne Probleme loswerden könnten. Erst ab 4 % wären wir nicht mehr imstande, CO2 mit der Atemluft abzuführen, was zum Erstickungstod führen würde. Weitere diesbezügliche Hinweise finden sich auch, wenn man die heutigen Erkenntnisse der Arbeitsmedizin einbezieht: Der MAK-Wert für CO2 liegt bei 5.000 ppm, recht nahe bei den vermutlich 6.000-8.000 ppm, die vor rund 550 Mio. Jahren in der Erdatmosphäre vorgelegen haben [MAK, ARBE, CALU]. Unser Körper ist offensichtlich seit Urzeiten darauf konditioniert, auch mit vielfach höheren atmosphärischen CO2-Gehalten als heute zurechtzukommen.
Der Calciumpuffer im Meer
Wie schon weiter oben ausgeführt, wirkt der Carbonatpuffer im Meer sehr ähnlich wie der im menschlichen Körper. Gegenüber der Situation bei pristinem Regenwasser muss man die Betrachtung um eine weitere Reaktion erweitern, nämlich um diejenige des Carbonats bzw. Bicarbonats mit Calcium-Ionen unter Bildung von Calciumcarbonat CaCO3 sowie Calciumdihydrogencarbonat Ca(HCO3)2. Während Regenwasser durch die Reaktion mit dem aus der Luft aufgenommenen CO2 einen pH-Wert von 5,5 annimmt, stellt sich bei zusätzlichem Kontakt von Regenwasser mit Marmor (dass ist ebenfalls Kalk) nach Auflösung von etwas Calciumcarbonat im Gleichgewicht ein pH-Wert von 8,3 ein [HÖLL].
Der Kontakt mit Calciumionen wirkt sich verstärkend auf die Wirkung des Carbonatpuffers aus. Bei den im Meer üblichen pH-Werten von 7,9 – 8,5 ist das Gleichgewicht der Carbonatreaktion soweit zur rechten Seite verschoben, dass fast nur Bicarbonat vorliegt. In diesem System hängt die Gesamtkonzentration von gelöstem, anorganischem Kohlenstoff (DIC = dissolved inorganic carbon; im Meer ca. 2,5 mmol/ l) von der Konzentration der gelösten Erdalkalien (vor allem Ca und Mg, Bild 9) ab. Mit ihnen bildet die Kohlensäure Salze, die dem Gleichgewicht entzogen sind. Dadurch kann weitere Kohlensäure gebildet werden und eine entsprechende Menge CO2 aus der Luft nachdiffundieren. Je mehr Calcium (und Magnesium) im Wasser enthalten sind, umso mehr DIC kann auch gelöst sein. Deshalb ist das erdalkalienreiche Meerwasser stark gepuffert, während weiche Süßwässer nur schwach gepuffert sind [SOMM].
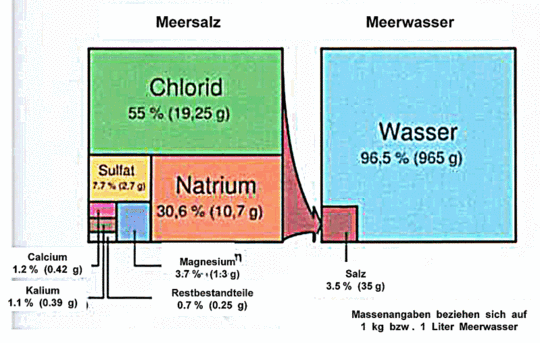
Bild 9. Wesentliche anorganische Ionen im Meerwasser (Grafik: [ETH])
Auch der emeritierte Geologieprofessor Dr. Friedrich-Karl Ewert und der Physikochemiker Dr. Siegfried Dittrich weisen in einer Untersuchung aus dem Jahre 2014 [EWDI] darauf hin, dass die aus magmatischen Gesteinen stammenden stark basischen Alkali- und Erdalkali-Elemente eine stabile Alkalinität des Meerwassers bewirken. Diese großen Mengen starker Basenbildner sind so wirksam, dass sie eine Versauerung der Ozeane durch Bildung von Kohlensäure aufgrund des Zutritts von CO2 aus verschiedenen Quellen zuverlässig verhindern.
Der gleichen Ansicht ist auch Steve Burnett, der mit Blick auf die Puffer-Kapazität der Ozeane feststellt, dass „es chemisch wirklich unmöglich ist, carbonatabhängige Lebewesen im Wege einer Ozean-Versauerung durch CO2 zu schädigen“ [BURN]. Er weist darauf hin, dass sich die meisten kalkschalenbildenden Organismen zu einer Zeit entwickelten, in der die CO2-Konzentration über 8.000 ppm lag. Es sei unverständlich, wieso man annehmen könne, dass solche Organismen, deren Vorgänger in einem Umfeld aufgeblüht seien, das durch CO2-Konzentrationen von bis zu > 8.000 ppm (d.h. um > 2.000 % über dem heutigen Pegel) geprägt war, heute mit einer Zunahme von lediglich 30 % nicht zurecht kommen sollten.
Die Tricks der Pufferleugner
Das Interessante an der Diskussion über die angebliche Meerwasserversauerung ist, dass diejenigen, welche diese These vertreten, im Prinzip selbst Leugner sind: Sie leugnen Tatsachen, die längst als Stand der Wissenschaft gelten. Dabei werden teils plumpe Tricks eingesetzt, vor allem dann, wenn man es mit Laien zu tun hat, welche die Materie nicht kennen.
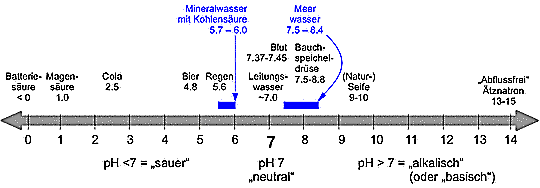
Bild 10. Die pH-Skala mit Kennzeichnung von Mineralwässern und der natürlichen Variabilität von Meerwasser (Grafik: Steiner [STEI])
Diesen setzt man dann oft falsche, im Prinzip als unredlich einzustufende Erklärungen und Pseudo-Experimente vor und führt sie dadurch in die Irre. Auf diese Weise werden dann Journalisten, Politiker, Lehrer oder Schüler indoktriniert. Ein häufig anzutreffender Kniff besteht darin, die komplexen Wechselwirkungen des realen Milieus „Meerwasser“ zu verschweigen und mit hohen, völlig unrealistischen CO2-Konzentrationen z.B. in Mineralwasser, Bild 10, mit konzentrierten Säuren oder sonstigen unrealistischen Vorgaben zu arbeiten. Schon die Verwendung von Süßwasser bzw. CO2-angereichertem Süßwasser statt Salzwasser für Experimente, welche die „Meeresversauerung“ beweisen sollen, ist, wie oben dargelegt, ein Taschenspielerstrick.
Fred F. Mueller
Quellen
[ARBE] http://tinyurl.com/kheuz5z
[BLUT] http://evobioblog.de/der-evolutionsbeweis-unserem-blut/
[BURN] http://www.eike-klima-energie.eu/news-cache/ozean-versauerung-welche-ozean-versauerung/
[CALU] Berger, W. H.: Carbon Dioxide through Geologic Time, http://tinyurl.com/5u8sa7
[CHEM] https://www.chemiezauber.de/inhalt/basic-1/wasser-2/wasserstoffbr%C3%BCcken.html
[ETH] http://e-collection.library.ethz.ch/eserv/eth:2576/eth-2576-05.pdf
[EWDI] http://www.eike-klima-energie.eu/news-cache/versauerung-der-ozeane-geo-chemisch-unmoeglich/
[GOLD] http://oceanservice.noaa.gov/facts/gold.html
[HÖLL] Höll, Karl: Wasser : Nutzung im Kreislauf, Hygiene, Analyse und Bewertung / Karl Höll. Hrsg. von Andreas Grohmann. – 8, völlig neu bearb. Aufl. – Berlin, New York: de Gruyter, 2002, ISBN 3-11-012931-0
[INTE] http://www.chemie-interaktiv.net/bilder/salz_wasser.swf
[MAK] http://tinyurl.com/gwfdeo3
[NEKA] http://evobioblog.de/der-evolutionsbeweis-unserem-blut/
[OZEA] https://fmss12ucheme.wordpress.com/2013/05/05/ocean-acidification-2/
[SOMM] Sommer, Ulrich: biologische Meereskunde, S. 35. (Springer-Lehrbuch). ISBN 978-3-540-63512-3
[STEI] http://www.eike-klima-energie.eu/news-cache/versauern-die-ozeane-die-phaelschung/
[URAN] http://tinyurl.com/lyumzux
[WIDI] https://commons.wikimedia.org/wiki/File:Water_molecule.svg
[WIME] https://commons.wikimedia.org/wiki/File:Karbonatsystem_Meerwasser_de.svg
[WIPH] https://de.wikipedia.org/wiki/PH-Wert
[WIME] https://commons.wikimedia.org/wiki/File:Karbonatsystem_Meerwasser_de.svg
[WIPU] https://de.wikipedia.org/wiki/Kohlens%C3%A4ure-Bicarbonat-System



Sehr geehrter Herr Müller, ich bewundere Ihre Geduld in der Diskussion mit „Gläubigen“. Endlich hat sich ‚mal jemand gefunden, der versucht hat, mit dem chemischen Unsinn der Meeresversauerung aufzuräumen! Ebenso wie Herr Weißenborn sage ich Ihnen auch als mathematisch, chemisch, physikalisch (aus)gebildeter Geologe (soll nicht unbescheiden sein-mein nicht deutsches Studium ist daran Schuld!) „Gute Darstellung, Herr Müller“
@ # 21 Marvin Müller
Lieber Hr. Müller,
Sie sind zwar hartnäckig, aber von den falschen Vorstellungen geleitet. Der Begriff „Versauerung“ ist im Zusammenhang mit den Meeren eine Irreführung, auch wenn er von interessierter Seite jetzt inflationär in die Weltöffentlichkeit posaunt wird. In der Medizin gibt es schon seit sehr langer Zeit die Begriffe „Azidose“ und „Alkalose“ für Abweichungen des gepufferten pH’s im Körper vom Referenzwert. Azidose ist eine Störung des Säure-Basen-Gleichgewichts zugunsten der sauren Valenzen (Zunahme H+-Ionen abgebender chem. Verbindungen), Alkalose das Pendant zur basischen Seite hin. Solche Begriffe hätte man korrekterweise für Veränderungen des pH-Werts innerhalb des alkalischen Bereichs im gepufferten Meerwasser verwenden müssen. Stattdessen hat man den Begriff „Versauerung“ gewählt, obwohl dieser anders belegt ist. Das ist nicht Wissenschaft, sondern Ideologie. Punkt, Ende der Diskussion, auch wenn es Ihnen nicht gefällt.
Der Rest Ihrer Einlassungen bezüglich der Reaktionen von diversen Kommentatoren oder seitens des Admins ist – freundlich ausgedrückt – etwas wirr. Es macht keinen Sinn, darauf einzugehen.
Was Ihre Aussage zu wissenschaftlicher Arbeitsweise angeht, die Sie bei mir anzweifeln, so weiß ich ja nicht, welchen Hintergrund Sie haben. Dieser Aufsatz ist keine Doktorarbeit. Ich muss nicht jeden von vielen Tausend Leuten, die auf einem Fachgebiet jemals etwas veröffentlicht haben, aufführen. Ich muss lediglich den Stand der Wissenschaft als solches korrekt berücksichtigen. Die beiden Professoren, die sich mein Papier durchgesehen haben – und die beide zig Diplomanden und Doktoranden betreut haben – haben diesbezüglich keine Einwände geltend gemacht. Seien Sie mir deshalb nicht böse, wenn ich mich an deren Beurteilung halte. Es sei denn, Sie könnten mir eine ausreichende Qualifikation glaubhaft nachweisen. Aber nach dem, was ich hier von Ihnen bisher gelesen habe, würde mich das doch eher überraschen.
Mfg
#1: Marvin Müller sagt:
Wissenschaftliche/Technische Begriffs-Definitionen:
Das Wort „sauer“ ist mit dem pH-Wert < 7 verbunden. Das Wort "alkalisch" ist mit dem pH-Wert > 7 verkünpft.
+ Die Versauerung bezeichnet den Vorgang der Erniedrigung vom pH-Wert, so dass das Milieu stärker sauer wirkt.
+ Die Entsäuerung bezeichnet den Vorgang der Erhöhung vom pH-Wert, so dass das Milieu weniger sauer wirkt.
+ Die Neutralisierung bezeichnet den Vorgang der pH-Wert-Änderung, so dass das Milieu weder sauer noch alkalisch wirkt.
+ Die Alkalisierung bezeichnet den Vorgang der Erhöhung vom pH-Wert, so dass das Milieu stärker alkalisch wirkt.
+ Die Entalkalisierung bezeichnet den Vorgang der Erniedrigung vom pH-Wert, so dass das Milieu weniger alkalisch wirkt.
Man müsste korrekterweise von einer Entalkalisierung der Ozeane sprechen, eine Versauerung findet also laut der Begriffsdefinition nicht statt.
Wie im Kommentar zu #1 geschrieben: Begriffe besetzen und umdeuten ist ein altbekanntes politisches Kampfmittel.
Mfg
Werner Holtz
#20: Peter Schmitz sagt:
„Liebe CO2 – Freunde, sehr geehrter Herr Hader,
ich nehme von meiner Aussage nichts zurück.
Tatsache ist, und davon sprach ich, dass das Protoplasma bei einem sauren pH-Wert denaturiert. Das können Sie ja einmal mit Eiern ausprobieren.[. . . ]“
############
Sehr geehrter Herr Schmitz, Sie sagten in #14
„[. . . ]würde der pH-Wert im Wasser unter 7 sinken, führte das dazu, dass das Protoplasma in der Zelle, das aus Eiweißstrukturen besteht, denaturiert. Damit wäre das Leben im Meer zu Ende. [. . . ]“
Das liest sich für mich so, als sei ein Leben im Wasser bei einem pH unter 7 nicht möglich.
Nun gibt es aber bei uns viele Fließgewässer, deren pH unter 6,5 liegt in denen die Bachforelle gedeiht.
Wie sagten Sie so schön:
„[. . . ] manche Diskussionen aus biologischer Sicht verfolgt, kann man wirklich nur den Kopf schütteln über so viel Dummheit. [. . . ]“.
#18: Fred F. Mueller sagte am Mittwoch, 10.02.2016, 18:36:
„@ # 16 Marvin Müller
ich fürchte, ich muss doch mal den Begriff „Versauerung“ ein wenig klarstellen. Den gibt bzw. gab es schon lange in den Agrarwissenschaften, dort ist er klar definiert und bezeichnet Böden, deren pH-Wert unter 7 bis an die 5 abgesunken ist.“
Schön. Hier geht es aber nicht um Böden. Es geht um einen anderen Kontext und was mit dem Begriff Ocean Acidification in diesem Kontext gemeint ist, habe ich im ersten Kommentar geschrieben.
„Hr. Weissenborn ist nach meinem Kenntnisstand ein hoch qualifizierter, als Gutachter tätiger Diplom-Geologe mit sehr fundierten Kenntnissen auf dem Gebiet. Ich rechne es mir als Ehre an, wenn er zu meinem Aufsatz anmerkt: „Gute Darstellung, Herr Müller!““
Das schützt ihn aber nicht davor, sich hier zu irren. Und schön wieder mal zu sehen, dass Sie an dem eigentlichen Punkt meiner Aussage vorbeischreiben. Der war nämlich — um ihn nochmal zu wiederholen — dass Herr Weissenborn ein falsches Verständnis des Begriffs Ocen Acidification hat, obwohl ich in #1 klargestellt habe, was in dem hier relevanten Kontext gemein ist. Der Admin, der in der #1 kommentiert hat, hat es verstanden.
„Auch die Herren Schmitz und Adam haben keinesfalls Ihre Vorstellung gestützt, im Gegenteil.“
Wie kommen Sie darauf? Wo schreibe ich, dass die beiden meine Vorstellung stützen? Können Sie den Teil vielleicht mal zitieren, den Sie so verstanden haben?
„Was Judith Curry angeht, so ist dies eine US-Amerikanerin, mit der ich leider keine deutschen Aufsätze diskutieren kann. Ich habe meine Arbeit – wie es im wissenschaftlichen Bereich guter Usus ist – deshalb von deutschen Fachleuten gegenlesen lassen, an deren Unabhängigkeit ich keinen Zweifel habe. Beide sind Professoren auf ihrem Gebiet (Geowissenschaften bzw. Physikalische Chemie), und beide stützen die von mir vertretenen Ansichten. “
Naja, wissenschaftliche Arbeit besteht ja nicht nur darin, eigene Dinge zu schreiben und von anderen beurteilen zu lassen. Es geht auch darum, zu wissen, was andere auf dem Fachgebiet so tun und zu welchen Ergebnissen die kommen.
# 19
Liebe CO2 – Freunde, sehr geehrter Herr Hader,
ich nehme von meiner Aussage nichts zurück.
Tatsache ist, und davon sprach ich, dass das Protoplasma bei einem sauren pH-Wert denaturiert. Das können Sie ja einmal mit Eiern ausprobieren.
Ebenso gerinnt es bei zu hohen oder zu niedrigen Temperaturen.
Aber:
Im Laufe von Millionen von Jahren haben sich Schutzmechanismen sowohl für den pH-Wert als auch für Wärme oder Kälte gebildet.
Man müsste nur einmal untersuchen, wie diese Mechanismen bei Aquarienfischen aussehen.
Mit freundlichen Grüßen
Peter
#14: „würde der pH-Wert im Wasser unter 7 sinken, führte das dazu, dass das Protoplasma in der Zelle, das aus Eiweißstrukturen besteht, denaturiert. Damit wäre das Leben im Meer zu Ende.“
Sehr geehrter Peter Schmitz, Aquarianer haben in ihren Wasserbacken einen pH-Wert von bis zu 6. Trotzdem haben sich ihre Aquarien nicht in eine Ansammlung toten Materials verwandelt.
„Wenn man manche Diskussionen aus biologischer Sicht verfolgt, kann man wirklich nur den Kopf schütteln über so viel Dummheit.“
In Anbetracht Ihrer obigen Aussage, sollten Sie sich das ggf. noch mal überlegen.
MfG
S.Hader
@ # 16 Marvin Müller
Lieber Hr. Müller,
ich fürchte, ich muss doch mal den Begriff „Versauerung“ ein wenig klarstellen. Den gibt bzw. gab es schon lange in den Agrarwissenschaften, dort ist er klar definiert und bezeichnet Böden, deren pH-Wert unter 7 bis an die 5 abgesunken ist.
Das ist etwas völlig anderes als der ideologische Angst- und Kampfbegriff von der „Meeresversauerung“, auch deshalb, weil die chemischen Zusammenhänge gänzlich unterschiedlich sind.
Wenn Sie so hartnäckig darauf aus sind, auf dem Thema herumzureiten, erwarte ich zunächst von Ihnen, dass Sie sich selbst informieren und Fakten bringen. Mit Ihren hier geäusserten Interpretationen tun Sie sich m.E. keinen Gefallen:
Was die Kommentatoren #13, 14 (und 15) angeht, so haben Sie sich da wohl ein wenig vertan. Hr. Weissenborn ist nach meinem Kenntnisstand ein hoch qualifizierter, als Gutachter tätiger Diplom-Geologe mit sehr fundierten Kenntnissen auf dem Gebiet. Ich rechne es mir als Ehre an, wenn er zu meinem Aufsatz anmerkt: „Gute Darstellung, Herr Müller!“
Auch die Herren Schmitz und Adam haben keinesfalls Ihre Vorstellung gestützt, im Gegenteil. Es ist mir rätselhaft, wie Sie deren Aussagen so interpretieren, wie Sie es jetzt tun. Im Gegenteil, ich beziehe die Aussage von Hr. Schmitz : „Wenn man manche Diskussionen aus biologischer Sicht verfolgt, kann man wirklich nur den Kopf schütteln über so viel Dummheit.“ jedenfalls nicht auf mich.
Was Judith Curry angeht, so ist dies eine US-Amerikanerin, mit der ich leider keine deutschen Aufsätze diskutieren kann. Ich habe meine Arbeit – wie es im wissenschaftlichen Bereich guter Usus ist – deshalb von deutschen Fachleuten gegenlesen lassen, an deren Unabhängigkeit ich keinen Zweifel habe. Beide sind Professoren auf ihrem Gebiet (Geowissenschaften bzw. Physikalische Chemie), und beide stützen die von mir vertretenen Ansichten.
Mfg
# 16
Liebe CO2 – Freunde, sehr geehrter Herr Müller,
um es noch einmal klar und deutlich zu machen, für mich ist und bleibt der pH-Wert des Meeres eindeutig im basischen Bereich. In diesem Zusammenhang sei erwähnt, dass sämtlich Organismen im Meer im Lauf von Millionen von Jahren genetisch einen Toleranzbereich „erworben“ haben, der ihnen das Leben ermöglicht. Nichts Anderes habe ich zum Ausdruck bringen wollen.
Die Aussage, dass ein pH-Wert unter 7 dem Leben auf der Erde ein Ende bereiten würde, war so zu verstehen, dass auch der letzte ohne Vorkenntnisse den Zusammenhang verstehen sollte.
Mit freundlichen Grüßen
Peter
#10: Fred F. Mueller sagt am Freitag, 05.02.2016, 19:25:
„@ # 6 Marvin Müller
Der Titel meines Aufsatzes lautet: „Warum die Ozeane nicht versauern können“. Das ist doch schon recht klar und eindeutig, oder?“
Dass da nicht so recht klar und eindeutig ist, sehen Sie an den Kommentaren #13 und #14. Die beiden Kommentatoren sind immer noch der Meinung, es ginge um eine Absenkung des PH-Wertes unter 7, obwohl hier in der Diskussion klargestellt wurde, dass es darum gar nicht geht. Sie haben da also eine Chance, etwas klarzustellen und Verwirrung aus der Diskussion zu nehmen. Warum Sie das nicht tun wollen, ist mir schleierhaft.
„Sie sind – was ich Ihnen nicht vorwerfen werde – viel zu gläubig gegenüber den wissenschaftlich stark anzweifelbaren Aussagen der „Meeresversauerungs-Apologeten“ bezüglich der angeblich bereits gemessenen pH-Wert-Änderungen im Meer. …
Wenn Sie das Thema interessiert, dann empfehle ich Ihnen eine nähere Beschäftigung mit den von mir angeführten Quellen, insbesondere mit Burnett sowie mit dem Prof. em. F.-K Ewert.“
Naja, ich bevorzuge da eher Quellen wie Judith Curry, die mal einen Übersichtsartikel zu dem Thema geschrieben hat (https://goo.gl/64yhqr : „Ocean acidification discussion thread“ oder teil zwei https://goo.gl/rDZIic) oder gar das Science and Public Policy Institut, das auch dazu schreibt. Keiner der beiden nicht gerade alarmistisch eingestellten ist der Meinung, der ph-Wert könne nicht sinken. Die diskutieren einfach den Sachverhalt, stellen klat, worum es geht (und auch nicht geht), wo die Unsicherheiten sind, … (Die haben auch den Vorteil, dass sie sich auf die sachliche Auseinandersetzung beschränken.)
Es gibt keine Meeresversauerung durch CO2 !
Die Zusammensetzung des Meereswasser
In den kalten Bereichen der Meere löst sich das Kohlendioxid im Wasser. Die sich bildende Kohlensäure ist im Meerwasser nicht stabil, sondern wird z. B. durch die vorhandene Kalzium- und Hydrogenkarbonate (Bikarbonate) sofort in Kalziumhydrogenkarbonat umgewandelt.
Kalziumhydrogenkarbonat ist gut in Wasser löslich und bleibt im Wasser nur beständig, wenn das Gleichgewicht mit der Konzentration an Kohlendioxid ausgewogen ist. Verschiebt sich das Gleichgewicht, zerfällt z. B. ein Teil des Kalziumkarbonates zu kaum löslichen Karbonat. Außerdem werden ständig unvorstellbare Mengen CO2 durch den Phytoplankton und Bikarbonat durch die Schalentiere und Korallen für die Bildung ihrer Kalkhüllen „herausgelöst“ und u. a. auch sedimentiert– siehe auch Kohlenstoffkreislauf. Der ständige Nachschub an Kohlendioxid ist also für diese Prozesse nötig!
Das Karbonatsystem bedingt mit ihren Salzen das Puffervermögen des Wassers für die sich bildenden schwachen Kohlensäure. Puffer haben die Eigenschaft bei Zugaben von Säuren (oder Basen), je nach Puffervermögen, den pH-Wert zu stabilisieren, dass keine nennenswerte pH-Wertänderung des Meerwassers (7,5 – 8,4) bei Eintritt pH-verändernder Stoffe erfolgt. Diese Eigenschaft des Hydrogenkarbonates wird als Säure-Bindungsvermögen (SBV) bezeichnet.
Eine wesentliche Rolle spielt das Gas Kohlendioxid, das in beträchtlichen Mengen im Meerwasser gespeichert ist. Und zwar wegen der Alkalinität des Meerwassers (überwiegend Kationen gegenüber Anionen) in viel stärkerem Maße, als es der Löslichkeit von Wasser oder wässrigen Salzlösungen entspricht.
Während die ganze irdische Lufthülle etwa 2.300 Gt Kohlendioxid enthält, findet sich in den Ozeanen etwa 50-mal so viel (1,3 10^14 t) teils gelöst, teils in Carbonaten (lösliche Hydrogenkarbonate). Die im Meer lebenden Pflanzen (vor allem das Plankton) können daher das zur Photosynthese benötigte CO2 direkt aus dem sie umgebenden Wasser aufnehmen.
Da das CO2 und seine Folgeprodukte (Hydrogenkarbonate) in einem chemischen Gleichgewicht stehen, bleibt der pH-Wert des Meerwassers sowohl bei Zugabe von Säuren, als auch bei Zugabe von Basen annähernd konstant. (S. 72/73)
In den Weltmeeren gibt es ca. 3.000 submarine vulkanische Lavaquellen und 100.000 bis 150.000 weitere CO2-Quellen. Es ist nicht bekannt, wieviel CO2 dadurch ins Meerwasser gebracht wird. Es gibt keinen einheitlichen pH-Wert der Weltmeere, sondern dieser schwankt zwischen 7,5 bis 8,4!
Quelle:
Die Umwelt des Menschen – Wie funktioniert das? Meyers Lexikonverlag, 1989
Und das CO2 ist weder „Luftschadstoff“, noch ein „Klimakiller“! Wer das behauptet, hat offensichtlich in der Schule die „Photosynthese“ verpennt! Ohne CO2 keine Pflanzen und keine Biomasse; ohne Pflanzen und Biomasse kein Futter für die Tiere und keine Nahrung für uns!
Ohne CO2 und Pflanzen keinen Sauerstoff – ohne CO2 kein Leben!
© – buhad 09/2008
Liebe CO2 – Freunde,
würde der pH-Wert im Wasser unter 7 sinken, führte das dazu, dass das Protoplasma in der Zelle, das aus Eiweißstrukturen besteht, denaturiert. Damit wäre das Leben im Meer zu Ende.
Übrigens darf ich darauf hinweisen, dass mindestens seit 3,5 Milliarden Jahren das Meer stets basisch gewesen ist, denn sonst hätten sich im Meer seit dem Start mit Cyanophyceen nicht vielfältige Lebensformen entwickelt.
Wenn man manche Diskussionen aus biologischer Sicht verfolgt, kann man wirklich nur den Kopf schütteln über so viel Dummheit.
Mit freundlichen Grüßen
Peter
#7 S. Hader,
—Yepp. So wie „Ökofaschismus“, „Ökodiktatur“, „Klimareligion“, „Flatterstrom“, „CO2-Lüge“…—
Machen wir weiter:
„Klimakatastrophe“, „Tipping point“, „Point of no return“, „unbewohnbarer Planet“, „Selbstverbrennung“, „Klimaflüchtlinge“. etc.
Gute Darstellung, Herr Müller!
Man braucht sich wirklich nur die kambrischen. mitteldevonischen und oberkretazischen Massenkalkvorkommen anzusehen, um zu erkennen, dass höhere atmosphärische CO2-Konzentrationen bisher nicht zu ph-Bedingungen des Ozeanwassers von unter 7 geführt haben.
#7: S.Hader sagt:
am Freitag, 05.02.2016, 17:25
#1: „Das ist ja genau der Zweck, warum der Begriff „Versauerung“ seitens seiner Erfinder gewählt wurde. Er soll negative Assoziationen, besser noch
Ängste erzeugen und tut dies auch. Genauso wie der Begriff Treibhauseffekt dies erfolgreich bewirkt.“
Hmm, ich habe mit dem Begriff Treibhauseffekt keine negativen Assoziationen. Zum einen ist ein Treibhaus eine gute Möglichkeit, um bestimmte Pflanzen zu kultivieren. Zum anderen hat dieser Effekt dazu geführt, dass es in unseren Breiten nicht grob 30 Grad kälter ist als heute.
######################################,
Ach Herr Hader, es gibt in der Troposphäre, analog zum Treibhaus, eine konvektionsunterdrückende Schicht? Das müssen Sie aber einmal erklären….
Cornwall und Hurd (CRES) haben untersucht, ob die zur „Ozeanversauerung“ durchgeführten Experimente von ihrer Auslegung her geeignete Methoden verwandten. Von den 465 Experimentenhaben nur 305 eine Beschreibung der Methoden, die eine Bewertung derselben erlauben. Von den 305, deren Beschreibung eine Bewertung erlauben, waren bei 278 die Methoden völlig ungeeignet.
Dann gibt es hier Leute wie die Herrn Hader und Marvin Müller, die die Unsinn der „Versauerung“ auch noch versuchen zu verteidigen.
MfG
P.S. paßt nicht Thema, aber doch wichtig: auf WUWT wird über eine Studie zur Fließgeschwindigkeit des Grönlandeises der Universität von Texas berichtet: danach ist das Grönlandeis in den letzten 9000 Jahren nie langsamer geflossen als heute und in der Mitte nimmt das Eis zu.
@ # 6 Marvin Müller
Lieber Hr. Müller,
Sie schreiben: „Verstehe ich das jetzt richtig: Sie nehmen an, dass selbst die in der Wissenschaft diskutierte Abnahme des ph-Wertes um .1 (bereits beobachtet) bzw. .5 bis Ende des Jahrtausends nicht möglich ist? Das sich der ph-Wert also gar nicht ändern kann?“
Der Titel meines Aufsatzes lautet: „Warum die Ozeane nicht versauern können“. Das ist doch schon recht klar und eindeutig, oder?
Sie sind – was ich Ihnen nicht vorwerfen werde – viel zu gläubig gegenüber den wissenschaftlich stark anzweifelbaren Aussagen der „Meeresversauerungs-Apologeten“ bezüglich der angeblich bereits gemessenen pH-Wert-Änderungen im Meer. Der pH-Wert im Meer hat eine sehr hohe Variationsbreite, die selbst durch den blauen Bereich in Bild 7 nicht ausreichend wiedergegeben wird. Es wurden auch schon Werte > 10 gemessen. Einflussgrössen sind u.a. Temperatur, Salzgehalt, biologische Aktivität, Wassertiefe, Jahreszeit, Tageszeit etc. Hier mit Durchschnittswerten zu hantieren ist ziemlich gewagt. Es hat nie flächendeckende und zeitlich langdauernde Messkampagnen von ortsfesten Positionen in ausreichender Dichte aus gegeben. Historische Werte aus Proxies ermitteln zu wollen halte ich für – gelinde ausgedrückt – eher mutig. Selbst heute ist der Umgang mit pH-Sensoren eine Wissenschaft für sich. Ich empfehle Ihnen, den Beitrag von Burnett hierzu zu lesen: Das ist jemand, der die Dinge aus der Praxis kennt und m.E. zutreffend beschreibt. Und lassen Sie sich nicht täuschen, wenn er sich selbst als „Student“ bezeichnet, das halte ich für typisch angelsächsisches Understatement. Schauen Sie mal in einer Suchmaschine nach.
Aus meiner Sicht halten die derzeitigen Angaben bezüglich eines Absinkens des pH-Werts der Ozeane einer fundierten wissenschaftlichen Analyse nicht stand, und was die Zukunft angeht, so gestehe ich derartigen Prognosen, die auf Simulationen beruhen, kaum einen Anspruch auf Glaubwürdigkeit zu.
Wenn Sie das Thema interessiert, dann empfehle ich Ihnen eine nähere Beschäftigung mit den von mir angeführten Quellen, insbesondere mit Burnett sowie mit dem Prof. em. F.-K Ewert.
Mfg
Ich nehme mal an, der Anteil an Kraftwerken, die fossile Brennstoffe ohne Schwefelfilter verbrennen, dürfte weltweit steigen. SO² löst sich prima im Wasser der Atmosphäre, verdrängt darin gelöstes CO² und bildet Schwefelsäure. Das ist eine eine richtige Säure, die verdrängt dann alles, was mit CO² zu tun zusätzlich noch. Die Meldungen über das Waldsterben mögen ja für Deutschland West übertrieben gewesen sein. Im Erzgebirge aber, war der Wald tot, so weit man sehen konnte. Ich habe das gesehen.
Bevor ich also an die Versauerung der Meere durch CO² glaube, verlange ich einen 15 minütigen Vortrag darüber, bei dem der Vortragenden vorher jeweils ein Glas verdünnte Batteriesäure und ein Glas konzentrierte Kohlensäure (Mineralwasser spritzig) leert. Wenn er danach noch reden kann, sehen wir weiter.
P.S. zahlreiche Schwermetalle bilden saure Salze durch Komplexbildung mit OH-, in vielen Länder gelangt dieser Dreck auch ungeklärt in die Meere. Kümmert auch keinen Klimaprediger.
In#4muessen Sie H2CO3 im Meerwasser beruecksichtigen gemaehss http://tinyurl.com/ElexierDesLebens18 oder wie soll das CO2 das Sie in #4 anfuehren dort vorliegen? als kleine Gaskugel vielleicht?
Doch wie das so mit Wasser ist, viele Loesungspartner verunmoeglichen die einzelnen Loesungsbestandteile zu finden.
Sauer oder basisch wird ja nur aus den H+ oder OH- ionen verifiziert. Entscheidend ist ja dann der Saeurerest zu was dann dieses Gebrodel tut. Und von einer Uebersaettigung kann man getrost ausgehen, sonst gaebe es ja keine Muschelschalen, keine Korallen, keine Sedimente. Was nicht zuletzt dem H+ Ueberschuss aus geloestem CO2 in Regen“wasser“ zu verdanken ist.
#1: „Das ist ja genau der Zweck, warum der Begriff „Versauerung“ seitens seiner Erfinder gewählt wurde. Er soll negative Assoziationen, besser noch
Ängste erzeugen und tut dies auch. Genauso wie der Begriff Treibhauseffekt dies erfolgreich bewirkt.“
Hmm, ich habe mit dem Begriff Treibhauseffekt keine negativen Assoziationen. Zum einen ist ein Treibhaus eine gute Möglichkeit, um bestimmte Pflanzen zu kultivieren. Zum anderen hat dieser Effekt dazu geführt, dass es in unseren Breiten nicht grob 30 Grad kälter ist als heute.
„Begriffe besetzen und umdeuten ist ein altbekanntes politisches Kampfmittel.“
Yepp. So wie „Ökofaschismus“, „Ökodiktatur“, „Klimareligion“, „Flatterstrom“, „CO2-Lüge“…
#4: Fred F. Mueller sagt am Freitag, 05.02.2016, 14:07:
„im Meerwasser sind von der Grössenordnung her so rund 0,004 g/l Co2 und 0,42 g/ l Calcium gelöst. Das Gewichtsverhältnis ist also ca. 100 zu 1. Ich sehe keine Chance, dass ein wenig mehr CO2 die Pufferwirkung des Ca. überwinden könnte.“
Verstehe ich das jetzt richtig: Sie nehmen an, dass selbst die in der Wissenschaft diskutierte Abnahme des ph-Wertes um .1 (bereits beobachtet) bzw. .5 bis Ende des Jahrtausends nicht möglich ist? Das sich der ph-Wert also gar nicht ändern kann?
Dann wäre das erst recht wichtig, das im Artikel anzumerken.
Meersalz ist das was verdunstetes Meer“Wasser“ uebrig laesst.
Und verdunsten -also wieder zu Gas werden- tut das fluessige Loesungsmittel „Wasser“ aus den an sich geloesten Bestandteile reinen Wassers H2O und Kohlendioxid CO2 als Gas.
Dies im Verhaeltnis was die darueberliegende Luft aus deren Druck und Temperatur zulaesst. Angeregt und beeinflusst durch der Sonne Strahlung, – welche ja bekanntlich auch zur natuerlichen Radioaktivitaet beitraegt.
Oder kurz gesagt:
Es verdampft halt nicht nur Wasser, wenn eine Regenpfuetze austrocknet.
Auch in diesem Pfuetzenwasser geloestes CO2 – in Form von H2CO3 -geht ueber in den Dampf -also gasfoermigen Zustand, wird also wieder molekulares CO2.
Uebrig bleiben die in Luft schwerer loeslichen Bestandteile. Hier beim Meerwasser also die Stoffe fuer das Meersalz. Zu den groessten Teilen Chlorid und Natrium also Kochsalz.
Eine Uebersaeuerung der OZEANE aus CO2 – also aus dem „Wasser“enthaltenden H2CO3 kann also gar nicht stattfinden, solange die Luft genuegend CO2 aufnehmen kann – also diese Loeslichkeit des Stoffes CO2 in der Luft nicht gestoert ist.
Und mit der Temperatur der Luft auch erhoehtem Druck nimmt ja bekannter Mahssen die Faehigkeit „Wasser“ eben in diese Luft zu verdunsten zu.
Welche Rolle spielt also der Saettigungsgrad an Wasserdampf in Luft zur Faehigkeit also Affinitaet CO2 in diese Luft aufzunehmen?
Weil Wasserdampf ist ja das Klimagas Nr.1 veranwortlich fuer Klima 30 mal staerker als CO2.
Sehr schoener Artikel!
Danke Herr Mueller!
@ # Marvin Müller
Lieber Hr. Müller,
im Meerwasser sind von der Grössenordnung her so rund 0,004 g/l Co2 und 0,42 g/ l Calcium gelöst. Das Gewichtsverhältnis ist also ca. 100 zu 1. Ich sehe keine Chance, dass ein wenig mehr CO2 die Pufferwirkung des Ca. überwinden könnte.
Mfg
#2: Fred F. Mueller sagt am Freitag, 05.02.2016, 12:30:
„Lieber Hr. Müller,
ich kann Ihren Einwand nicht so recht nachvollziehen.“
Sie scheinen meine Anmerkung nicht verstanden zu haben. Lesen Sie doch einfach nochmal in Ruhe nach und wählen dann im einfachsten Falle eine der beiden Varianten. Das wäre hilfreicher, statt einfach weiter nebulös von Versauerung zu reden, falls Ihnen bewusst sein sollte, dass es da verschiedene Varianten gibt …
@ # 1 Marvin Müller
Lieber Hr. Müller,
ich kann Ihren Einwand nicht so recht nachvollziehen. Die Ozeane können nicht versauern, sie waren selbst bei 6.000 ppm nicht „versauert“, sondern strotzten vor Leben. Das ganze Gerede von „Versauerung“ und „Schädigung kalkschalenbildender Organismen“ ist unwissenschaftlich. Gehen Sie ins nächste Naturkundemuseum und schauen Sie mal in die Fossiliensammlungen.
Mfg
Es würde dem Artikel glaube ich gut tun, wenn der Begriff Versauerung mal definiert werden würde. Es gibt ja oftmals das Problem, das Leute denken, es würde einen ph-Wert < 7 bedeuten, während in Wirklichkeit ein Absinken des ph-Wertes von etwa 8.1 auf 7.6 gemeint ist (und die 7.6 auch erst zum Ende des Jahrhunderts).